针对PD-L1的癌症光免疫疗法可能对没有高表达特异性抗原的患者有效 - 名古屋大学
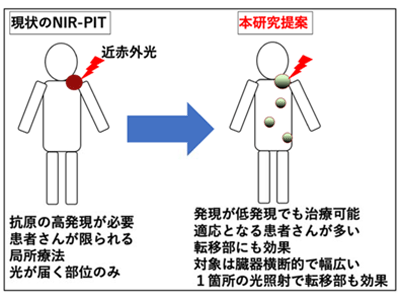
近红外光子免疫疗法需要目标抗原的高度表达,限制了其可用于的患者数量。
名古屋大学11月2日宣布,该校已成功开发出一种针对免疫检查点分子PD-L1的近红外光免疫疗法的应用,以提高癌症免疫力。 该研究由该大学研究生院呼吸医学系的研究生Shunichi Taki(在研究时,他是博士课程的第四年,目前在爱知县健康、福利和农业合作社联合会的Konan Kosei医院呼吸医学系工作)、该大学的高等研究所、JST探索性研究支持计划(探索性研究计划的第一学期)挑选的研究人员以及JST科学和技术人力资源开发财团共同完成。 (B3单位:文部科学省青年科学家新领域创建研究单位),以及东京大学呼吸医学系S-YLC特别助理教授Kazuhide Sato。 该研究结果发表在《美国科学》杂志上。 该研究的结果已经发表在《癌症免疫治疗杂志》(电子版)。
PD-L1是免疫检查点蛋白PD-1的配体,在广泛的实体瘤中被检测到。PD-L1存在于肿瘤细胞膜中,通过抑制CD8(+)T细胞的免疫反应和逃避免疫监视而发挥作用。目前正在开发针对各种器官的PD-1/PD-L1靶向免疫检查点抑制剂。 PD-1/PD-L1靶向的免疫检查点抑制剂现在已经被证明对各种器官的癌症有效。 即使在肿瘤表达低水平的PD-L1(TPS:肿瘤比例得分≥1%)时,它们也可以作为一线治疗,并且已知具有一定的疗效。 然而,这种效果是不够的,需要开发能够增强免疫检查点抑制剂效果的技术。
近红外光免疫疗法是由美国国立卫生研究院和国家癌症研究所(NCI/NIH)的小林久隆博士及其同事在2011年开发的一种新的癌症疗法。 一种专门识别癌细胞所表达的蛋白质的抗体和光敏物质IR700的复合物被合成,与细胞表面的目标蛋白质结合,并用约690纳米的近红外光照射以破坏细胞。 这些细胞死亡机制在2018年被S-YLC项目助理教授Kazuhide Sato及其同事证明是一种基于光化学反应的细胞死亡新概念。 它有望成为继手术、放疗、化疗和免疫疗法之后的 "第五种癌症治疗方法",因为它能以不同的方式瞄准和摧毁癌细胞。 2020年9月,该药物被授予早期有限批准,用于治疗表达高水平表皮生长因子受体的复发性头颈癌。
然而,传统的近红外光免疫疗法,包括这次批准,需要一个在癌细胞上高度表达的癌症靶抗原,这限制了能从这种治疗中获益的病人的数量。 有必要将这种创新的光靶向癌症疗法广泛提供给患者,以便将其作为一般的标准疗法。 为了克服这个问题,该研究小组决定把重点放在PD-L1上,这是一种免疫检查点分子,在各种癌症中的表达量并不高,而是低度到中度,并在癌症免疫的基础上开发一种近红外光免疫疗法。 他们还发现,这种治疗方法能协同增强癌症免疫检查点抑制剂的效果。
PD-L1靶向小鼠实验中的肿瘤抑制和生存期延长
该研究小组首先合成了一种由抗小鼠PD-L1抗体转化为F(ab')2(PD-L1 F(ab')2)、PD-L1 F(ab')2和光敏剂IR700组成的复合物,以形成PD-L1 F(ab') F(ab')2-IR700是通过合成PD-L1 F(ab')2与光敏剂IR700复合物而制备的,由于没有PD-L1抗体的非特异性结合,预计会减少全身性的副作用,并且与IgG相比具有更小的尺寸和更高的肿瘤渗透性。
利用这种PD-L1 F(ab')2-IR700,我们研究了针对小鼠异体肿瘤细胞(肺癌、结直肠癌、前列腺癌和黑色素瘤)的近红外光免疫疗法。 与EGFR在肿瘤中的表达相比,PD-L1的表达很低,不到百分之一,而EGFR目前被批准用于人类。 众所周知,这种疗法的效果取决于癌细胞膜表面的癌症抗原的表达。 在细胞实验中,与表达高水平表皮生长因子受体的肿瘤相比,以PD-L1为目标的近红外光疗的效果更为有限,后者需要更强的光能来摧毁细胞。 在足够的光能下,近红外光免疫疗法在细胞实验中也有细胞毒性作用。 因此,在细胞实验中,PD-L1靶向的近红外光疗的疗效有限,不适合用于治疗。
然而,当使用PD-L1 F(ab')2-IR700的单剂量近红外光疗在小鼠同种异体肿瘤模型中进行研究时,观察到了明显的抑制肿瘤生长和延长生存期的效果,而这是无法从细胞实验的效果中预测的。 此外,在异体肿瘤移植的转移性小鼠模型中,仅用近红外光照射一个肿瘤就能抑制肿瘤的生长,并显著提高存活率,不仅是受照射的肿瘤,而且是未受近红外光照射的肿瘤。
癌症微环境的变化,在细胞实验中没有看到,是影响的关键
研究小组继续分析抗肿瘤免疫力,以澄清细胞实验与小鼠肿瘤治疗效果之间的差异。 他们发现,CD8(+)T细胞和NK细胞是抗肿瘤免疫的关键角色,在肿瘤内被激活。 对肿瘤微环境的详细分析显示,骨髓来源的免疫抑制细胞(MDSCs)数量减少。 研究发现,近红外光免疫疗法诱导的部分肿瘤坏死、PD-L1 F(ab')2的免疫检查点效应以及PD-L1 F(ab')2去除癌症微环境中MDSCs的微环境改造效应的协同作用,激活了抗肿瘤免疫,发挥了显著的抗肿瘤效果。 此外,对小鼠血液的分析表明,抗肿瘤免疫力得到了系统性的增强。 这种全身性的抗肿瘤免疫激活可能对没有经过近红外光免疫治疗和没有暴露在光下的肿瘤产生影响(光晕效应)。
预计将成为没有高表达特异性抗原的患者的替代疗法
这项研究表明,针对PD-L1的近红外光免疫疗法即使表达量有限,也有足够的抗肿瘤效果。 该研究还显示,PD-L1靶向的近红外光免疫疗法不仅在暴露于近红外光的部位有抗肿瘤作用,而且对转移性肿瘤也有作用。 结果表明,近红外光免疫疗法与传统的近红外光免疫疗法是一个不同的概念,后者针对的是高表达的分子,不表达相应的特异性癌症抗原的患者可能符合近红外光免疫疗法的要求。 该研究小组认为,该技术可以扩展到癌症患者身上,并且该方法可以很容易地应用于临床,因为PD-L1抗体已经得到临床批准。
开发的疗法有望在未来用于临床实践,作为近红外光免疫疗法的替代品,用于那些基于癌症特异性抗原高表达而不符合近红外光免疫疗法的患者。 这项研究将为实施针对人类恶性肿瘤的PD-L1的近红外光免疫疗法提供基础知识。


