ESMO2023 | 最新进展:乳腺癌(一)围手术期乳腺癌的治疗
2023年欧洲肿瘤内科学会年会(ESMO)在西班牙马德里举行。ESMO是欧洲乃至全球最负盛名和最具影响力的肿瘤学会议之一。来自155个国家的33,000多名临床医生和研究人员展示了2,600多项研究成果。其中包括许多非常重要的3期试验的结果,以及可能影响未来临床实践的众多值得关注的问题。
日本国立癌症研究中心肿瘤内科的专家从以下两个方面为大家分享了乳腺癌领域的最新成果。
1)围手术期乳腺癌
2)转移/复发性乳腺癌

先说说“围手术期的乳腺癌”。
激素受体阳性(HR+)HER2 阴性(HER2-)乳腺癌
大会报告了两项关于需要新辅助治疗的HR+/HER2-乳腺癌围手术期使用免疫检查点抑制剂的随机对照III期试验结果。两项试验均表明:新辅助化疗与免疫检查点抑制剂联合使用时,主要终点即病理完全缓解率得到改善。
●试验CheckMate 7FL (NCT04109066,LBA20)
该项研究纳入新诊断的ER+/HER2-(分期T1c-2、N1-2、T3-4、N0-2、GRADE2)[且ER 1-10%] 或GRADE3[且ER ≥ 1%]的早期乳腺癌患者521例入组。入组患者以1:1的比例被随机分配接受抗PD-1抗体纳武单抗组或安慰剂组。
在新辅助化疗阶段,患者接受纳武单抗或安慰剂联合紫杉醇治疗,然后接受纳武单抗或安慰剂联合AC(蒽环类药物联合环磷酰胺)治疗。纳武单抗的给药剂量为每3周360 mg 或每2周240 mg。手术后,两组患者均接受了研究者选择的内分泌治疗。纳武单抗组每4周接受480mg纳武单抗,持续7个周期作为术后治疗。最终,纳武单抗组89%的患者和安慰剂组91%的患者接受了手术。
试验结果显示:纳武单抗组的pCR率(病理完全缓解率)为24.5%,安慰剂组为13.8%(OR:2.05,95% CI:1.29~3.27,p=0.0021),具有统计学意义的显著改善。特别是,SP142中PD-L1阳性(IC ≥ 1)患者的pCR率为纳武单抗组的44.3%和安慰剂组的20.2%(OR:3.11,95% CI:1.58~6.11),相差24.1%。
即:与单纯新辅助化疗RCB 0~1级相比,纳武利尤单抗联合新辅助化疗显著改善了ER+/HER2-早期乳腺癌患者的pCR率。
●试验KEYNOTE-756(NCT03725059,LBA21)
本研究纳入了1,278名新诊断为ER+/HER2-(分期T1c-2、N1-2或T3-4、N0-2,3级)的早期乳腺癌患者,并随机分配接受抗PD-1抗体帕博利珠单抗或安慰剂。在新辅助化疗阶段,患者接受帕博利珠单抗或安慰剂联合紫杉醇治疗,然后接受帕博利珠单抗或安慰剂联合AC(蒽环类药物联合环磷酰胺)或 EC(阿霉素和环磷酰胺)治疗。在完成手术后,患者每3周接受一次帕博利珠单抗200 mg 或安慰剂,持续6个月,再接受最长10年的内分泌治疗后,有条件者接受放疗。
该研究的两个主要终点是ITT人群最终手术时的pCR(病理完全缓解率)率和无事件生存率(EFS)。pCR定义为ypT0 ypN0和ypT0/Tis。
帕博利珠单抗组的pCR率为24.3%,安慰剂组为15.6%,显示出统计学意义上的显著改善(估计差异:8.5%,[95% CI:4.2 ~12.8],p = 0.00005)。特别是,约占总患者数75%的22C3 PD-L1 阳性(CPS ≥ 1)患者的pCR率差异为9.8%(95% CI:4.4~15.2),而PD-L1阴性(CPS < 1)患者的pCR率差异为4.5%(95% CI:-0.4 ~10.1),差距较大。
研究结论:帕博利珠单抗联合新辅助化疗可显著提高早期高危ER+/HER2-乳腺癌患者pCR率。
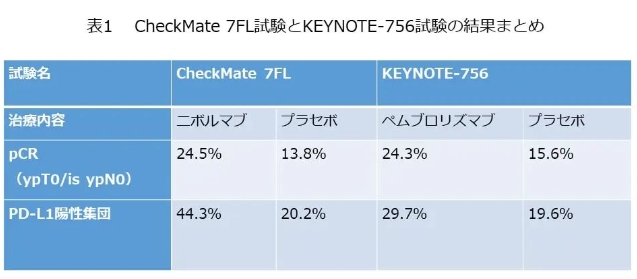
上表总结了CheckMate 7FL 和KEYNOTE-756两项试验的结果。两项试验均显示:新辅助化疗在联合抗PD-1抗体后,pCR率提高了约24%,但仍然需要长期随访,以确认是否真实改善EFS和OS。
特别是,在HR+乳腺癌中,pCR不是Luminal A 型(分子生物学分类)的有利预后因素,而是Luminal B 型的预后因素,这表明pCR的预后意义可能因内在因素而异。因此,根据两项试验中由Grade和免疫组化筛选出的Luminal B-like,可以确定pCR在本次临床试验的目标人群中是否仍然是一个良好的预后因素,问题是它在长期预后中的意义目前尚未明确。
即使是在评估将联用pembrolizumab(帕博利珠单抗)作为三阴性乳腺癌围手术期治疗药物的KEYNOTE-522试验中,FDA也没有仅凭pCR的改善就批准pembrolizumab,CheckMate 7FL 和KEYNOTE-756试验的结果不太可能会使ER+乳腺癌患者获得批准,因为FDA在批准前获得了EFS结果(pembrolizumab组5年的最新EFS为81.3%,安慰剂组为72.3%,HR:0.63 [95% CI:0.49-0.81])。
另一个问题是术后内分泌治疗。根据monarchE的试验结果,在高危病例中,术后可使用阿贝西利后联合内分泌治疗。本次ESMO报告的第三次中期OS分析中,5年时阿贝西利组的IDFS(无浸润性肿瘤复发生存率)为 83.6%,安慰剂组为76.0%,(HR:0.680,95% CI:0.599 ~0.772),在长期的随访跟踪后,阿贝西利并未显现出更好的效果。
另一方面,纳武单抗、阿贝西利和内分泌治疗联合治疗转移性和复发性乳腺癌(WJOG11418B NEWFLAME试验 ),以及纳武单抗、帕博西尼(palbociclib)和阿那曲唑(Anastrozole)联合治疗作为术前治疗(CheckMate 7A8试验)都会导致超过30%的患者出现3级以上肝功能障碍,导致治疗中止。未来免疫检查点抑制剂、CDK4/6抑制剂和内分泌治疗联合疗法的安全性可能值得怀疑。这是一个值得关注的问题。
三阴性乳腺癌NeoTRIP试验(NCT002620280、LBA19)
NeoTRIP试验将TNBC患者随机分配接受8个周期的白蛋白紫杉醇+卡铂(化疗组)和白蛋白紫杉醇+卡铂+ atezolizumab(阿特珠单抗组)。
主要终点是EFS(无事件生存期),次要终点是pCR率(病理完全缓解率);之前仅报告了pCR率。在ITT分析中,与未使用atezolizumab(阿特珠单抗)的患者(44.4%;OR:1.18,95% CI:0.74~1.89,p = 0.48)相比,使用atezolizumab(阿特珠单抗)后的 pCR率(48.6%)有统计学上的显著显着改善。在多变量分析中,PD-L1表达的存在与否是影响pCR率最大的因素(OR:2.08)。
中位随访54个月后,本次公布的EFS率,不含atezolizumab(阿特珠单抗)的单纯化疗组为74.9%,而阿特珠单抗组为70.6%(HR:1.076,95% CI: 0.670 ~1.731)。因此,主要终点EFS也没有显示出统计学上的显著差异。
使用atezolizumab(阿特珠单抗)作为术前抗癌药物的IMpassion 031试验显示pCR有所改善,但病例数导致无法评估DFS和OS,并且ESMO BC2023上的报告没有显示出明显的差异。另一方面,KEYNOTE-522的结果恰恰相反,因为添加pembrolizumab(帕博利珠单抗)改善了pCR和EFS。
如上所述。NeoTRIP试验与KEYNOTE-522试验的不同之处在于,术后治疗中没有使用免疫检查点抑制剂,并且蒽环类药物没有与免疫检查点抑制剂联合作为术前抗癌治疗,可能是使用了不同的免疫检查点抑制剂,但尚不清楚这些因素在多大程度上发挥了作用。


