日本2015癌症骨转移指南(1)
2015年版
编辑 日本临床肿瘤医学会
协助 日本骨外科学会
日本泌尿科学会
日本放射线肿瘤学会
原著发行商 株式会社江南堂
译者 富 啸
日本发行骨转移诊疗指南的目的
发生骨转移的癌症患者较多,在过去的解剖案例中可知,前列腺癌和乳腺癌患者约有70~80%发生骨转移,肺癌约有40%存在骨转移。骨转移引起疼痛、骨折、脊髓压迫、高钙血症等,如果不能较好的控制骨转移,患者的生活质量将蒙受巨大损失。
止痛、放疗、手术是传统的骨转移治疗方法,近几年新开发的骨修饰剂、骨水泥治疗显著提高了骨转移控制率,进一步遏制了骨转移造成患者生活质量下降的状态。但是这些治疗方法的科学依据和临床实践仍有不足。
就此现状,在骨科医学会、泌尿科医学会和放射肿瘤学会的协助下,日本临床肿瘤医学会组织编纂了骨转移诊疗指南,试图给更多的临床医生参考,并希望该诊疗指南能为提高癌症患者的生活质量做出贡献。
日本临床肿瘤学会 理事长
大江 裕一郎
翻译指南的目的
癌症的骨转移发生率较高,骨转移严重影响了患者的生活质量,就骨关联事件(SRE)的处理标准亦不统一,之前还没有世界标准的骨转移诊疗指南。于2015年出版发行的日本《骨转移诊疗指南》从骨转移的发生,流行病学、病理学、生物学、治疗目的和治疗方法等方面对癌症的骨转移诊疗进行了全面的科学论证,给出了诊疗指引,内容详实;参与编篡的专家委员会由日本国内的肿瘤内科、骨科、介入科、核医学科、病理科、放疗科、影像诊断科、姑息治疗科、口腔科的30名权威专家组成,他们参考了日本国内以及全世界的339篇文献,医学证据和临床经验都值得信赖。我全文翻译了指南的核心部分,希望患者及患者家属在科学、客观的理解癌症的基础上,能更早期地正确对待骨转移,理解并配合医师的诊治,收获更好地生活质量。
该译文并不是我国官方推荐的诊疗标准,仅供读者参考。诊疗请以医师的诊断和处方为准。
原版指南于2015年3月由日本出版商“江南堂”在日本国内发行。本译文为非卖品,任何以商业利益为目的使用本译文的行为,发生著作权等法律后果时须自行承担,译者概不负责。
为了简明扼要,该译本上除了原文对专家委员成员的介绍,以及各专家与外部的利益关系说明(日本要求参与制定指南的专家声明与医药厂家的利益关系),以及专用名词解释部分。
译者富 啸
2021年1月
指南译文的阅读方法
原版日本骨转移指南的正文分总论和Clinical Question两部分,针对每个具体问题,CQ以问、答和解说的方式阐述。本译文就以上两个部分做了全文翻译,省略了医师利益相关、专业术语解释的附件部分。指南的科学依据来自2003年至2013年期间的339篇医学文献,文末记载了这些文献的索引。
【科学依据强弱度的示意】A=强 B=中 C=弱 D=非常弱
【诊疗方法推荐度的示意】强推荐=推荐实施或不实施,弱推荐=建议实施或不实施
【专家委员会合意率】制定本指南的专家委员会对该项治疗的推荐活建议结论,投赞成票的专家比率。
总论1骨转移的病理状态
1. 流行病学
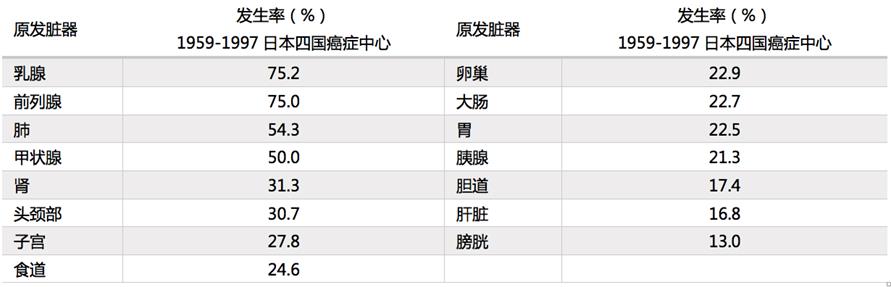
近年发现几乎所有的癌症都可能遭遇骨转移,在癌症患者的日常诊疗中,医师应该重视骨转移的发生。现在的大背景:①治疗方法的进步延长了癌症患者的生存期;②其他疾病(脑卒中等)的致死率下降造成了(译者注:人类寿命延长)癌症发生率上升;③影像诊断器械发展了,而目前全世界仍没有对癌症的骨转移发生率的完整报告。森脇等对解剖案例的骨转移情况做出统计(表1)。报告中,乳腺癌、前列腺癌发生骨转移的有75%,肺癌、甲状腺癌的有50%。消化系统癌症的(消化道、肝胆胰)约20%,消化系统癌症的骨转移发生率低,但是患者基数大,实际发生骨转移的胃癌、大肠癌患者人数非常多,不可忽视。
表1.按肿瘤发生部位分的骨转移发生率
2. 病理学
目前认为血行转移是骨转移(包括骨髓转移)的主要途径。通常,将发生骨转移的癌症定义为临床Ⅳ期进展性肿瘤。多数骨转移按腰椎、胸椎、颈椎、骶骨的顺序转移,四肢骨的转移较少,末梢骨转移罕见。
骨转移局部发生纤维化、坏死(凝固坏死或出血坏死)、形成骨岛,可发现病灶周围的造骨功能变化。按骨骼的反映点可以将转移病灶分为成骨性转移、溶骨性转移、骨小梁间转移、混合转移4类。局限于脊柱的骨转移按照小梁间转移、成骨转移、溶骨转移、混合转移的次序发生。实际上,成骨和溶骨的混合型转移较多,目前将混合型分为成骨为主、溶骨为主、骨小梁间为主的三种类型。发生了压缩性骨折的脊椎转移和微转移很难归属为以上4个类型中的1个。
主要发生成骨性转移的患者中,前列腺癌最多,也常见乳腺癌和胃未分化癌。骨转移灶周围会发生成骨细胞增殖、骨岛形成和溶骨。骨岛多形成于骨小梁周围(膜性骨化),也有小梁间腔的间质细胞骨化的。这种转移在骨折、活检中发现频率都很低,而且活检很难取到充足的组织材料。
乳腺癌、肺癌、甲状腺癌、未分化胃癌、各脏器的鳞癌常发生溶骨为主的转移。因为骨小梁被破坏,骨被吸收,溶骨性转移常发生骨折。常出现骨折,骨小梁被不规则吸收的现象,而且随着骨转移的进展,骨髓间质反应明显,乳腺癌的骨转移最具代表性。
与骨髓转移的概念相似,骨小梁间转移是癌症骨转移的初期现象,不发生成骨、骨吸收、破骨,临床很难发现,大多数是微小转移灶,最后转变为其他类型的骨转移。在胃未分化癌和小细胞肺癌中可以看到这种病灶发展的过程。骨间质转移有时会引发弥散性血管内凝血综合征(DIC)。
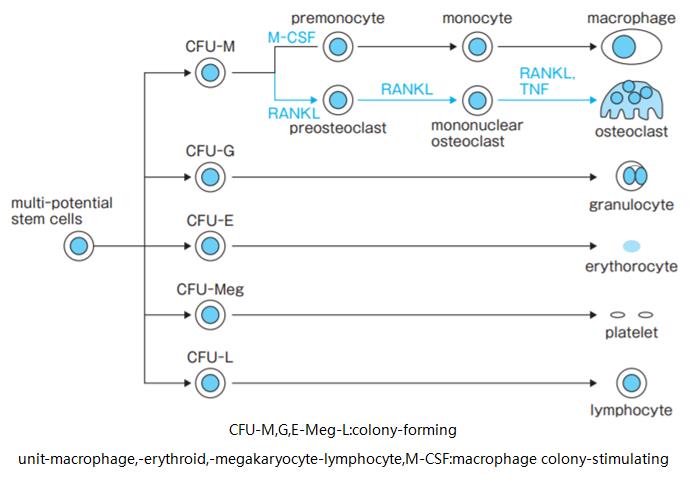
图1.成骨细胞的分化
CFU-M,G,E-Meg-L:colony-forming unit-macrophage,-erythroid,-megakaryocyte-lymphocyte,M-CSF:macrophage colony-stimulating factor
3. 细胞生物学
癌细胞在发生脏器转移前要经历各种过程,脏器转移的形成取决于癌细胞和脏器微环境的相互作用。种种试验和临床所见发现,骨转移的形成与癌细胞、骨微环境,特别是破骨细胞和成骨细胞的相互作用有关。
到达骨的癌细胞为自身创造增殖空间,首先破坏骨。发生骨吸收的主要力量是破骨细胞,它不仅在溶骨性转移中发挥作用,在成骨性转移中也发挥重要作用。破骨细胞来源于血液干细胞,巨噬细胞类单核细胞在RANKL(receptor activator of nuclear factor kappa-B ligand)的帮助下分化、融合成多核巨细胞。RANKL主要发现于成骨细胞的细胞膜上,它与破骨细胞前体的RANKL结合,促进破骨细胞的分化、激活和生存,增强骨吸收。成骨细胞同时分泌decoy recptor的osteoproterin(OPG)来抑制破骨细胞活性。
人们发现,促进破骨细胞形成和激活刺激因子的RANKL增多后,在parathyroid hormone-related protein(PTHrP)、前列腺素、interleukin(IL)-1、IL-6、IL-11、tumornecrosis factor-α(TNF-α)、macrophage inflammatory protein 1(MIP1)作用下进一步增加了成骨细胞RANKL的阳性表达。另一方面,骨基质富含生长因子insulin-like growth factor(IGF)、transforming growth factor-β(TGF-β)、epidermal growth factor(EGF)、bone morphogenetic(BMP),随着骨吸收的进行,这些因子被释放,成长因子向癌细胞供给,骨转移灶进一步发展。如此,癌细胞与骨转移就形成了恶性循环(图2)。此外,癌细胞与成纤维细胞、血管内皮细胞、免疫细胞之间的相互作用也很重要。
图2.细胞与成骨细胞、破骨细胞的相互作用
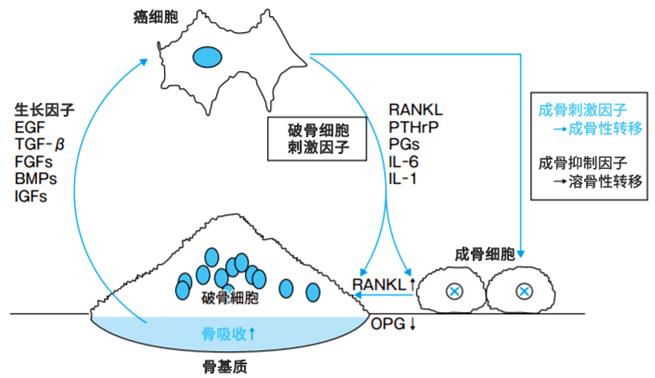
在以上机制中,使用双磷酸盐(唑来膦酸)抑制破骨细胞,使用抗RANKL抗体(地蒂诺单抗)抑制破骨细胞后阻挡骨吸收,可能会抑制骨转移的形成和发展。这些用于临床治疗的抗骨转移药物统称为骨修饰剂(bonemodifyingagents:BMA)。调整成骨细胞功能,阻断成骨细胞抑制因子的方法可能对溶骨性转移有效,但还没有用于临床治疗。
总论2骨转移的诊断
1. 门诊
医生门诊接收晚期癌症患者时,应留意骨转移。不同癌种的骨转移发生率不同,骨转移关联事项(skeletal related event:SRE)的发生频率也因癌种不同。有文献报告了晚期癌症的全程随访中发生骨转移的几率,乳腺癌65~75%,前列腺癌65~75%,甲状腺癌40~60%,肺癌30~40%,膀胱癌40%,肾癌20~35%,恶性黑色素瘤14~45%,消化道癌5%。骨转移高频发生的癌种依次为:乳腺癌、前列腺癌、甲状腺癌、肺癌、膀胱癌、肾癌、多发性骨髓瘤,出诊时应特别注意。
初期发生骨转移时多数患者无症状,患者首次被诊断为骨转移时无症状的占27~60%。骨转移的常见症状有疼痛、骨髓压迫、病理性骨折等,骨折风险和病理性骨折、骨髓压迫、高钙血症需要紧急处理(可参考CQ2、6、7)。
2. 生化学
a) 钙
诊断骨转移时,建议测量血钙浓度。发现癌症患者有高钙血症时,需留意骨转移(可参考CQ2)。
b) 骨代谢标志物
骨代谢标志物分为骨形成标志物和骨吸收标志物。骨形成标志物有:骨碱性磷酸酶(bone specific alkaline phosphatase:BAP)、骨钙素、Ⅰ型原胶原羟基端前肽(procollagen typeⅠ N-terminal propeptide:PINP )、Ⅰ型原胶原氨基端前肽(procollagen typeⅠ C-terminal propeptide:PICP)等。骨吸收标志物有:Ⅰ型原胶原交联前肽(procollagen type Ⅰ cross-linked N propeptide:CTx)、(carboxyterminal telopeptide of type Ⅰ collage:1CTP)、脱氧吡啶啉(deoxypyridinoline:DPD)、吡啶啉(pyridinoline:PYD)、抗酒石酸酸性磷酸酶5b(tatrate-resistant acid phosphatase-5b:TRAPC5b)等。在癌症的骨转移中,有时会出现骨代谢标志物升高,经过双磷酸盐、抗RANKL抗体等BMA抑制骨吸收后,这些标志物会下降。
3. 影像诊断
影像学诊断骨转移时常用X光、computed tomography(CT)、magnetic resonance(MRI)、骨扫描、(FDG-PET)CT,这些检查方法单独使用时都不能完美诊断,往往需要多个影像检查方法并用(CQ3)。
a) 骨转移的形态学影像诊断
骨转移病态的骨破坏不是癌细胞的直接浸润,而是被破骨细胞溶解后间接形成的。使用X线、CT诊断时,在形态学上局部骨吸收或成骨均反映为异常阴影,根据骨小梁被破坏的影像来诊断。影像诊断时还必须注意形态学上直接浸润之外的所有因素。破骨细胞诱导的骨组织在骨转移病灶中被吸收。癌的种类(性质)不同,影像是不一样的,增殖速度快的癌细胞在骨组织被吸收的空间分裂、增殖;增殖速度慢的癌细胞经成骨细胞重塑在骨组织被吸收的空间造骨。
形态学诊断时转移灶的部位和图像类型鉴别非常重要。癌的骨转移发生于红髓,注意其分布,向脂肪髓的转移为二次转移,很少向皮质骨和骨膜下转移。脊椎是骨转移的易发部位,骨转移所见中椎弓根被破坏,后弯、前弯、侧弯整个锥体被破坏的影像比较少见,通常椎间盘腔被保留。
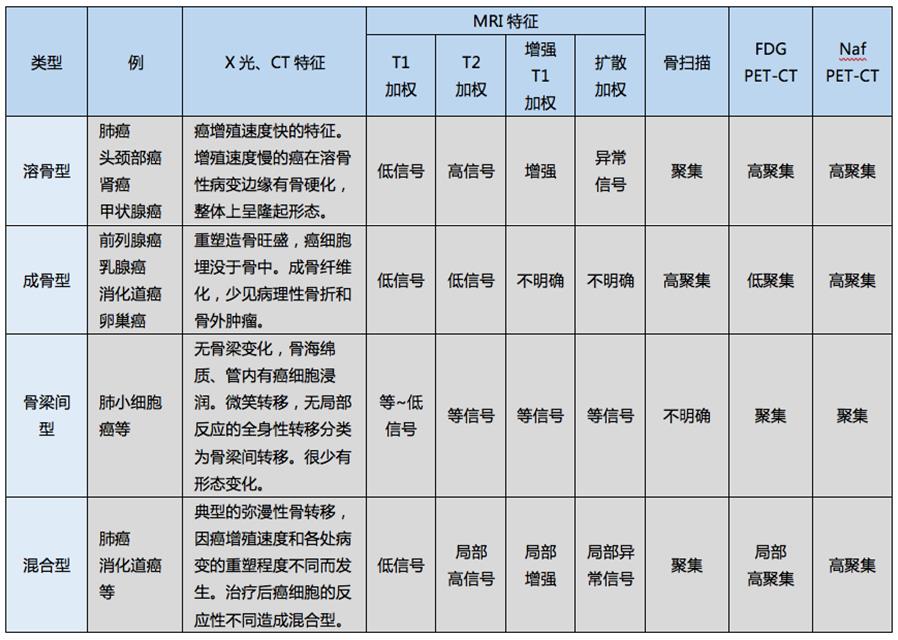
按骨转移的影像类型分,主要有溶骨型、成骨型、骨小梁间型和混合型(表1)。这4种类型的骨转移并不是孤立存在的,他们总有密切的联系,总是在溶骨转移和成骨转移这两级间变化。除此之外还有特殊类型:Paget型、osteopathiastriata型、坏死型。
表1.骨转移的图像类型和特征
MRI无法捕获到骨皮质信号,很难描绘出骨构造的破坏,诊断时需要对比X光或者CT的影像。扩散加权的MRI对骨转移的敏感度高,容易把握骨转移的进展程度,有发现骨转移的优势(图1)。多通道磁共振可以对躯干部检查,提高了骨转移的诊断效率。使用自旋回波T1加权像和短T1 inversion recovery(STIR)像,可拍摄全脊椎矢状面影像、fast field echo(FE)T1加权影像和STIR脂肪抑制的全身冠状面影像,用b值600~1,000sec/mm²的DWIBS可以拍摄扩散加权图像。
b) 骨转移的功能学影像诊断
骨扫描是骨转移诊断的标准。骨组织的基本成分是羟基磷灰石Ca10(PO4)6(OH)2,显影剂可与羟基磷灰石结合。发生骨转移时,无机物的代谢、重塑亢进,造成放射核素聚集。骨扫描可以映射骨的代谢反应,除了癌,骨代谢的良性病变也反映为阳性(假阳性)。因此,诊断时需要形态学影像检查来弥补骨扫描的这个缺陷。
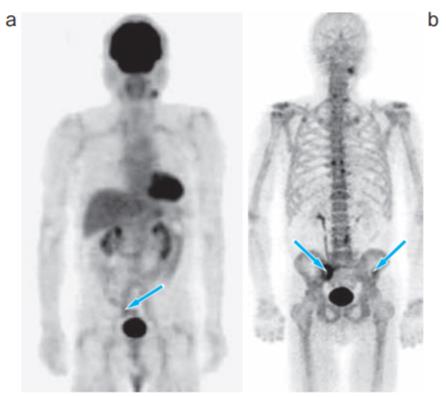
18F-FDG-PET/CT可以成像癌细胞亢进的糖代谢,对骨转移的诊断有意义(图2)。虽然PET/CT对不活跃的肿瘤和细胞密度低的肿瘤FDG聚集不足,但是对骨转移的诊断很有效。PET/CT也有很多缺陷,①炎症病灶呈假阳性;②脑、尿路的生理性FDG聚集影响图像;③高血糖时FDG聚集不足。
NaF-PET/CT的氟化钠与羟基磷灰石结合,能得到比骨扫描更好的高清晰影像。使用氟化钠显影剂的高感度PET/CT对骨转移的检出最准确(图2)。
最新的混合型影像检查设备PET/MRI具有卓越的组织对比能力及低辐射优点。不仅对骨转移,对脑转移的诊断也值得期待。
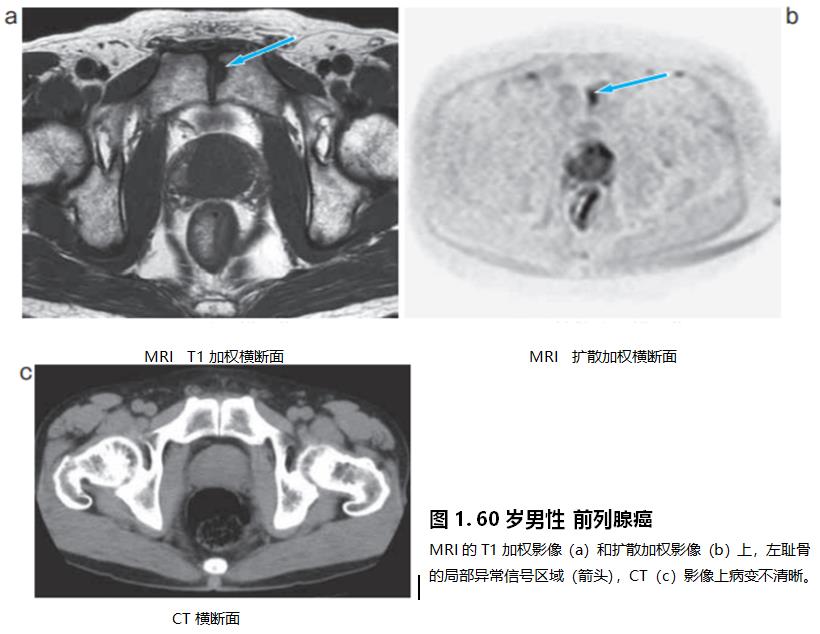
图2. 70岁男性 头颈部癌
FDG-PET/CT可见骶骨异常聚集。
NaF-PET/CT除了骶骨,可见左盆骨有异常聚集。
总论3骨转移的治疗和康复
1. 骨科治疗的意义
骨科医师负责评估骨转移、脊椎转移的状态,力学强度,神经学诊断,必要时提示患者回避受力、使用辅助装备,行手术治疗等。
a) 治疗对象
从影像学上对骨转移进行诊断,如果肾功能和口腔状态尚可,可处方BMA药剂,患者有疼痛的,考虑放疗。进展缓慢的单发转移(肾癌、甲状腺癌等)考虑骨科的根治性手术。每个癌种的治疗策略都不一样。
当骨转移进展严重,疼痛剧烈,力学破坏和神经压迫严重时,有必要考虑骨科手术。发生脊髓麻痹的,原则上在48小时内手术,病理性骨折有必要尽早手术,衡量是否行手术治疗,取决于预判麻痹和骨折是否可以恢复。
骨转移通常预后不良,是否手术,采用何种术式等的判断都很难。常用预后预测评分系统对是否手术、姑息手术还是根治手术等进行治疗决策。
肺癌和乳腺癌原发的骨转移接受手术治疗的占骨转移总手术的4到5成,加上肾癌、前列腺癌、多发性骨髓瘤后占到8成。同时,各癌种的治疗方法迅速进步,靶向药物的出现给预后预测带来了重大改变。决定骨转移的治疗方针时,很有必要听取原发灶肿瘤治疗医师的意见。
除了手术之外,骨科还需考虑是否使用辅助装备(CQ8)和康复训练(CQ25)。采用外部放疗(CQ9)、介入放疗(CQ10、CQ11)、内部放疗(CQ24)、姑息治疗(CQ22,23)等手段前,建议这些局部治疗医师与原发灶治疗医师就患者是否适合这些治疗进行沟通。当前,不同医疗机构、不同医生间的治疗方针有较大的差异,治疗也要考虑患者的接受度,针对患者的骨转移治疗,应谨慎。
b) 手术治疗效果
据统计,骨转移手术后1年的生存率为17%~69%,差异很大。手术后的患者大多数改善了疼痛、患肢功能、神经症状,但也有并发症。围手术期内有静脉栓塞、肺栓塞、心肌埂塞、术中死亡等全身性并发症,以及后出血、术中骨折、感染、愈合不全、脱臼、神经损伤等局部并发症。据统计,上述任意并发症的发生率在0~5%之间,长管骨手术(100例以上的临床研究)后的并发症发生率为8~19%(CQ7)。后期并发症包括肿瘤的局部复发,再建材料的折损和损坏、固定不牢、再骨折等,可能导致再次手术。再手术的发生率为4~8%,治疗后的时间越延长,再手术的发生率越高。
2. 放射线治疗的意义
放疗对骨转移的疼痛是根治性疗法,如果有效,患者可减量或停止服用止痛药物。医师应该向患者说明放疗可缓解疼痛的意义,给患者自行决定是否接受放疗的机会。在WHO的癌痛治疗方法中也记载了考虑放疗处理骨转移疼痛。
放疗也可以用于骨转移带来的麻痹改善。特别在脊髓压迫症候群中,发生不可逆的,急速的双下肢完全麻痹,应尽早手术或放疗。推荐发症后48小时内开始治疗并没有科学依据,也不是超过48小时就不能治疗。紧急手术后,有必要术后放疗。
放疗也用于病理性骨折和脊髓压迫的预防性治疗。BMA具有降低骨折和麻痹风险的效果,正常骨髓不间断的供给破骨细胞,需要每3~4周向患者投放一次BMA。已经发生麻痹、骨折的。放疗效果无可期待,虽然没有相关对照试验的证据,但是我们认为预防性放疗对未发症的患者是有意义的。放疗后的钙化能使骨折风险降低也没有科学依据。
针对还没有确诊的恶性肿瘤,影像上已经诊断转移性骨肿瘤的,评估其有病理性骨折或脊髓压迫风险时,可以在明确诊断恶性肿瘤之前优先评估骨转移的状态,如果存在高风险,无需等待恶性肿瘤的确诊,可先行紧急手术或放疗。当患者疼痛强烈,预判检查期间患者将伴随疼痛的,可在完善检查前先行放疗。没有必要让患者等待不可直接获益的检查而耽误治疗,希望不要让患者无意义地疼痛。
3. 药物治疗的意义
实体肿瘤骨转移的药物治疗包括阻止癌细胞增殖或生存的化疗、内分泌治疗,和作用于破骨细胞的BMA治疗(CQ12~18,24)。抗癌药物治疗的详情,请参照各癌种指南。
a) 化学疗法、内分泌疗法
在临床试验中通常不评估骨转移的治疗效果,几乎没有单独针对骨转移治疗的临床试验项目。目前并没有药物治疗效果因转移部位变化的科学依据,评估骨转移反应的探索性研究认为化学疗法对骨转移病灶的奏效率为8~59%,内分泌疗法的奏效率为13~48%。通常,对performance status(PS)良好的骨转移晚期实体肿瘤采用化学疗法,对部分内分泌感受性癌采用内分泌疗法。
b) 骨修饰剂(BMA)
BMA在抑制破骨细胞分化、激活的同时通过诱导细胞凋亡来抑制骨的吸收。开发BMA的目的是阻断癌细胞与骨宿主细胞相互作用后而进入恶性循环。目前的BMA药剂有双磷酸盐和RANKL两类,BMA的使用目的是控制SRE(骨关联事件)。
双磷酸盐由可阻止生理性钙化的焦磷酸盐POP结构改造至P-C-P结构,对富含骨钙粒子的羟基磷灰石具亲和力。静脉注射双磷酸盐后约有一半的药剂聚集于骨,其余的不经过代谢直接由肾脏排泄。破骨细胞吸收的双磷酸盐通过甲羟戊酸的代谢路径而抑制法尼基焦磷酸酯合成酶,从而阻断下游促细胞增殖和运动的Ras、Rho、Rab等低分子G蛋白来抑制破骨细胞的骨吸收,双磷酸盐同时诱导破骨细胞凋亡。现在,日本针对乳腺癌的骨转移用注射用帕米膦酸二钠,其他实体肿瘤和多发性骨髓瘤的骨转移用唑来膦酸。
地诺单抗是抗体药物,它能抑制破骨细胞的分化和成熟所必需的RANKL。皮下注射的地诺单抗在机体中的利用率为60~80%,血中最高浓度为注射后的1~4周,血中半衰期为1~1.5个月。
须注意两种药剂的副作用,发热、无症状性低钙血症、肾功能障碍、腭骨坏死(ONJ)。
c) 放射性药剂
发射β射线的核素锶-89和钐-153等和发射α射线的核素镭-223(日本未使用)可用于骨转移的治疗。这些内部照射的药剂经静脉投放。与外放疗相比,其药理效果可遍及全身的骨转移病灶,主要用于缓解癌性疼痛。它们的有害事项包括白细胞和血小板减少。
4. 姑息治疗的意义
骨转移姑息治疗的意义在于缓解疼痛的同时,协助患者在骨转移和麻痹中生活。
骨转移的疼痛治疗,在安静时和活动时疼痛的治疗方法稍有不同。首先要确认患者疼痛属于安静疼痛还是活动疼痛,或者混合型疼痛。安静疼痛用非甾体药物、阿片类镇痛药物缓解(CQ22,23);应特别注意避免疼痛对患者夜间睡眠的影响。
体动疼痛需预防性给与解救性药物。酌情考虑疼痛治疗辅助类药物。为了最低限度的控制患者的动作疼痛,还需要将动作方式、辅助工具、环境调整的康复训练等组合(CQ8,25)。生活方式改变方面,在确保骨转移部位稳定的前提下,注意预防病理性骨折和麻痹。需要注意,仅有体动疼痛的患者,为了止痛逐渐加大非甾体药物剂量后,可能给患者带来困倦的副作用而导致生活质量下降。
药物治疗、放疗等其他治疗方法得联用也可能没有完全控制体动性疼痛,患者只能被迫改变生活方式。这些可能给患者带来社会性的和精神性的痛苦。骨转移部位的稳定、镇痛与预防病理性骨折的治疗,以及治疗界限,要根据事实情况以人为本地多方面考虑整体治疗对患者的影响。尊重患者个性的同时,确认患者和家属的愿望,合理地进行姑息治疗。
5. 康复训练的意义
此处的康复训练指物理疗法、动作控制疗法、语言疗法、以及对患者心理和教育训练。用康复训练治疗骨转移是没有科学依据的,但是康复训练与手术、放疗、BMA全身性药物治疗相结合,或者治疗后进行康复训练有利于患者缓解疼痛。虽然安静卧床可以规避SRE的风险,但是无法规避患者的日常活动(ADL)和QOL下降,以及废用综合征的发生。废用综合征可能给患者带来褥疮、深静脉血栓、坠积性肺炎等,造成死亡率升高。考虑风险的同时,从维持、提高骨转移患者ADL和QOL的角度考虑,建议康复训练。
6. 护理的意义
护理骨转移患者的目的之一是维持其QOL的同时协助患者获得最大限度的治疗效果。骨转移的患者不仅承受着身体的痛苦,还因对病情进展的不安,无法在家庭和工作中发挥作用而产生社会性的心理压力。针对患者的心理、社会性痛苦,家庭成员的看护也有意义。
a) 协助疼痛管理
时刻观察疼痛的部位、强度(安静/活动)、持续时间,确认患者对止痛药物的满意度。门诊患者的疼痛管理只能由自己负责,就阿片类止痛药物的使用方法和副作用处理,医师应该就疼痛无法缓解时再来复诊,疼痛管理的方法和具体知识进行患者教育。
b) 早期发现须紧急处理的骨转移症状
脊髓压迫是须立刻处理的症状之一,有脊椎转移的患者应听取关于脊髓压迫症状(CQ2)的说明。向患者说明,一旦出现症状须立刻联系救治,到达医院前不给脊椎受力。
疲倦和食欲不振是高钙血症的初期症状,肿瘤治疗的副作用也有类似症状,听取患者的描述,了解症状并测量血钙浓度。
c) 协助管理治疗的副作用
BMA治疗的副作用主要有低钙血症、肾功能损伤、ONJ等。预防低钙血症可以口服补充钙和维生素D,并注意临床血钙监测。保持口腔清洁可以预防ONJ,督促患者在骨转移治疗前接受口腔护理、调整义齿等。教育患者发现异常情况时立刻联系医师。
d) 协助日常生活
医师应就生活细节与患者交谈,有痛性骨转移患者的座立姿势,更衣,沐浴等日常生活动作受限,如何减轻骨转移部位的负荷、扭转受力和晃动,如何调整体位以适应生活环境。为了防止跌倒和病理性骨折,向患者及家庭成员说明如何保持安全的生活环境。
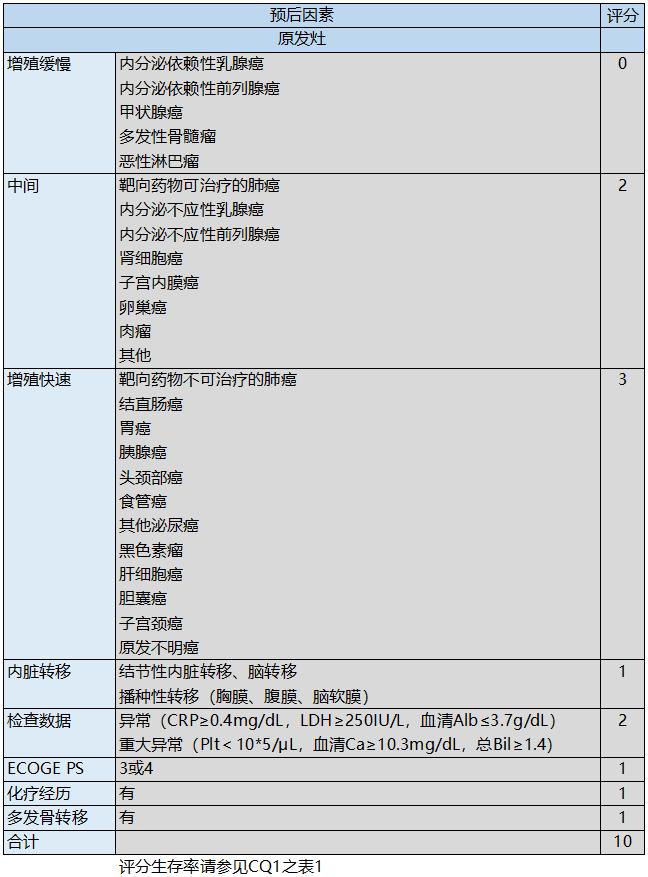
附件:骨转移预测评分工具
*原版指南该处为附件部分,为方便读者特添加至此处。
表1.评分方法对比
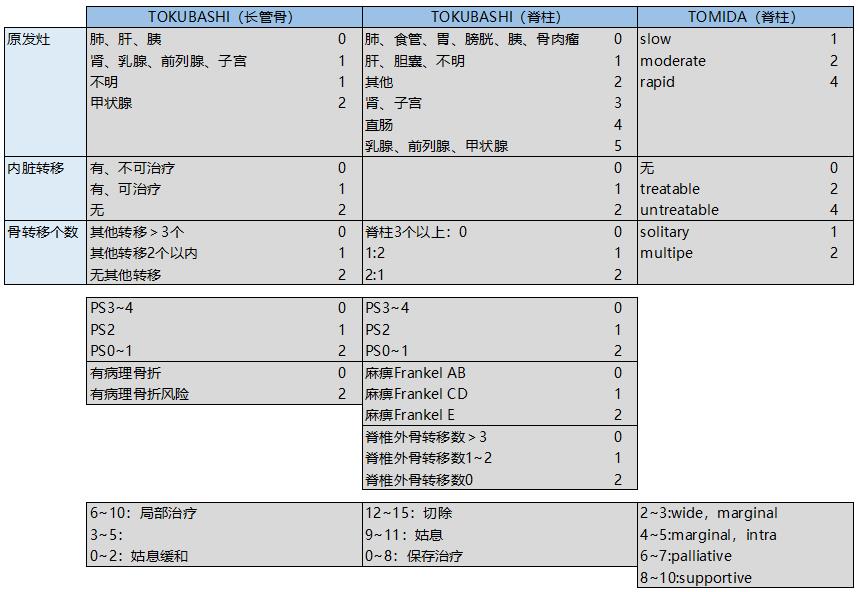
表2.Frankel分类(1969)
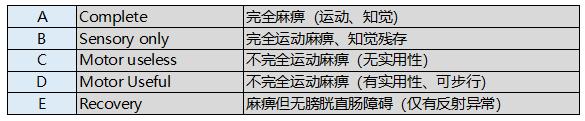
表3.Scoring system for Predicting Impending Pathological Fracturess(Mirels1989)
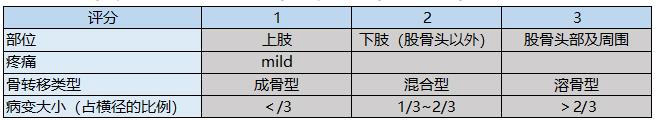
表4.Recommended Treatment due to Total Scoring Points(Mirels 1989)
表5.新katagiri生命预后评分