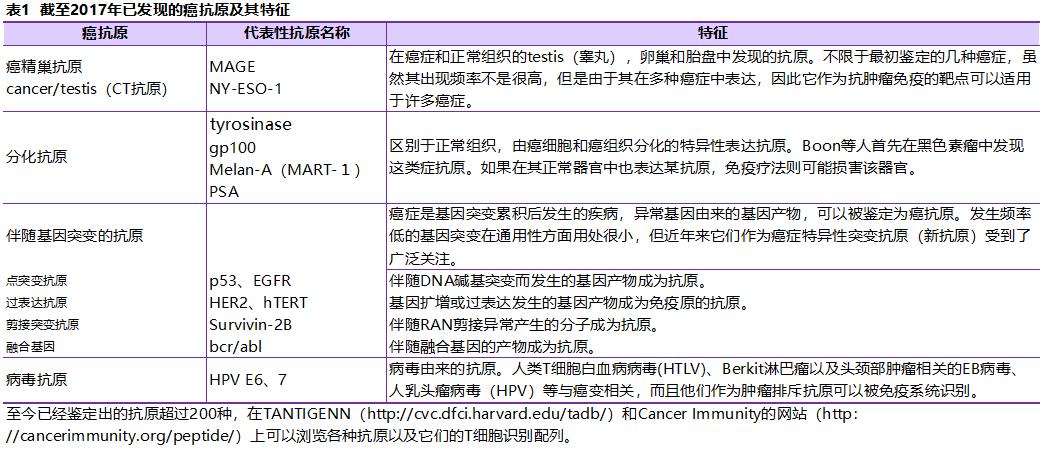
新生抗原和靶向新抗原的癌症疫苗疗法
日本国立癌症研究中心前端医疗研究中心
免疫疗法开发领域特任研究员 铃木利宙(SUZUKI Toshihiro)
免疫疗法开发领域长 中面哲也(NAKATUSRA Tetusya)
译文 胖墩儿
1、前言
继手术、放疗、化疗之后,免疫疗法作为癌症治疗的第四种疗法被给予期待,而免疫疗法的实际抗肿瘤效果长年受到质疑。近年出现的免疫检查点抑制剂显著且长期的抗肿瘤效果惊艳了世界。CD19阳性嵌合抗原嵌入T细胞疗法对血液肿瘤,浸润性T细胞疗法对黑色素瘤都显示出极高的疗效。今天已经没有人怀疑免疫防御理论和基于该理论的免疫疗法的有效性了。
免疫细胞在抗肿瘤免疫中承担了清除癌细胞的职能,T细胞、自然杀伤性(NK)细胞、NKT细胞、巨噬细胞、树突状细胞都是他们的代表。其中,CD8阳性T细胞具有很强的细胞伤害活性和增殖能力,CD8阳性T细胞通过识别主要组织相容性基因复合体(MHC)classⅠ分子提示的癌细胞高表达蛋白(癌抗原),来区分正常细胞与癌细胞。至2017年已经发现了200种以上的蛋白质可以作为癌抗原激活免疫,人们正在开发以这些抗原作为靶点的癌症疫苗,并进一步发现了肿瘤累积性基因突变来源的变异蛋白(Neoantigen)也可以用来清除癌细胞,很多文献报道了新生抗原与免疫检查点抑制剂的抗肿瘤效果相关。癌症患者的基因突变具有个体差异,全世界都在开发新生抗原的癌症疫苗,为患者提供个性化治疗。本文分别介绍相关抗原疫苗和新生抗原疫苗。
2、相关抗原的发现和相关抗原为靶点的癌症疫苗
以肿瘤抗原为靶点的癌症疫苗疗法引发严重有害事项的可能性非常低,是相当理想的治疗方法,为了寻找癌症抗原,人们做了很多科学研究。1991年柏林的Boon团队成功克隆了黑色素瘤患者的细胞杀伤性T细胞(CTL)可识别的癌抗原MAGE,首次在分子水平上明确了人类的肿瘤抗原。CTL可以识别来自抗原蛋白的8-12个氨基酸组成的肽与MHC classⅠ分子结合的复合体。当存在于细胞核和细胞质中的蛋白质被分解的抗原肽结合到MHC分子上时,它们可以显示在细胞表面并被T细胞识别(图1)。以这些癌抗原为靶点实施的免疫疗法有3个重要意义:①可能诱导癌症患者的免疫应答;②特意性发现癌组织;③肿瘤更难发生免疫逃逸。
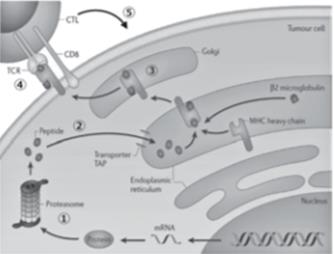
图1 由MHC class I分子衍生的内源性蛋白肽向T细胞呈递
①细胞内的蛋白被蛋白酶切割成肽片段。②肽片段被TAP分子吸收到内质网中,并与MHC I类分子结合。③MHC/肽复合体经高尔基体被转运至细胞表面。④CTL通过T细胞受体与MHC/肽复合物结合。⑤当发生强结合时,CTL被激活并发挥细胞毒性作用。
自Boon等人鉴定出MAGE之后,人们已经鉴定出了多种肿瘤排斥抗原和肽,1999年久留米大学开始了日本首次肽疫苗的临床试验。之后,日本进行了许多基于学术的由医生主导的肽疫苗的临床试验。美国NCI的Rosenberg S. A.团队将分化的抗原肽,以及与MHC classⅠ分子结合的亲和性更高的肽,用于疫苗疗法,对黑色素瘤患者进行了早期临床试验(图2)。在gp100肽疫苗+IL2与单独IL2的Ⅱ期对照实验中,证实疫苗提高了肿瘤的无进展生存期和有意义的辅助治疗效果,但没有达到治愈效果。单独癌症疫苗疗法的奏效率只有2.6%。日本国立中心发现了肿瘤特异性抗原GPC3,鉴定出可特异诱导CTL的抗原肽后,开展了针对晚期肝细胞癌的GPC3肽疫苗临床试验。疫苗的安全性和免疫学的有效性得到证实,后来技术交由企业孵化,现在企业正在针对晚期肝癌患者实施GPC3肽疫苗的临床试验。我们很期待今后肽抗原疫苗与免疫检查点抑制剂联合来增强抗肿瘤效果。
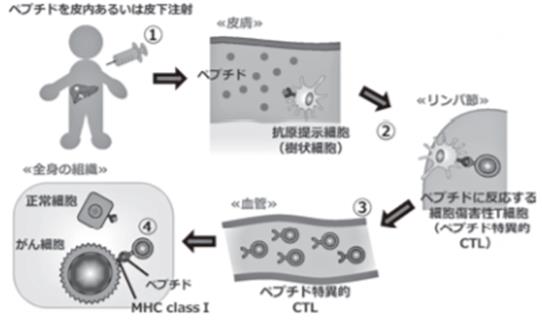
图2 肽疫苗疗法的作用机制
①使用可识别CTL的相关抗原或新生抗原合成抗原肽,结合免疫佐剂以皮下或皮内方式将抗原肽注射。②肽与抗原呈递细胞的MHC分子结合,在淋巴结中诱导、激活肽应答性CD8+T细胞。③被激活的CD8+T细胞分化成CTL,通过血管浸润癌组织。④CTL识别癌细胞MHC分子呈递的抗原肽后发动清除癌细胞的免疫反应。
3、新生抗原
肿瘤特异性突变抗原被称作新生抗原,现在很受关注。我们已经知道,紫外线照射可导致多种基因突变从而发生黑色素瘤;在因吸烟导致的肺癌中发现基因突变的大量累积。基因突变产生的氨基酸变化以肽的形式被MHC分子递呈后,被T细胞识别。从90年代到2000年初,发现肿瘤浸润T细胞移植疗法产生较高疗效的患者们,其基因突变来源的肽具有很高的免疫原性,它们更容易被T细胞识别。他们多数来自患者的自身突变,当时,虽然学术界关注到了新生抗原,但因其缺乏通用性,作为疫苗的靶点很难被临床运用。但是近几年人们发现,从免疫检查点抑制剂出现显著疗效的患者,他们的基因不稳定性更高,累积的基因突变更多。
基因测序技术的进步,可以对癌症患者的全基因进行鉴定,人们得以再一次关注基因突变来源的新生抗原可作为免疫疗法的靶点。
4、肿瘤浸润T细胞移植疗法与新生抗原的关系
美国NCI的Rosenberg S. A.等曾开发过多种肿瘤浸润T细胞移植的疗法。现在,针对晚期黑色素瘤,体外培养从肿瘤组织中分离的T细胞,再回注给事前将淋巴细胞全部消除的患者。超过70%的患者有效,非常成功。至此已经治愈了1,000多名黑色素瘤患者。我们知道紫外线造成了黑色素瘤患者的多重基因突变,突变基因产生变异的肽,被MHC分体呈递后,CTL更容易识别它们。这是该治疗方法具有高疗效的科学根据。同时,人们也从肿瘤内浸润T细胞移植疗法有效的很多患者中,鉴定到了能被T细胞识别的多种突变抗原肽。
5、免疫检查点抑制剂有效与基因突变的关系
正如前文所述,使用免疫检查点抑制剂的肿瘤免疫疗法引发了癌症治疗革命。也就是说,机体免疫本身可以拒绝癌症,不仅动物模型,这一理论被很多实际案例所证明。另一方面,它并没有对所有癌症患者起效,在实体肿瘤领域,最有效的黑色素瘤也不过3成有效。目前,PD-1抗体和CTLA-4抗体单独使用,联合使用的诊断预测、副作用预测成了迫切需要解决的课题。其中,增加基因突变产生的新生抗原和免疫检查点抑制剂的关系值得关注。在多个癌种上,从癌组织的全基因检测中发现基因突变的累积量比我们想象的多得多。与上皮生长因子受体EGFR等重要的驱动基因突变相同,基因突变的产物不仅可以成为治疗的直接靶点,人们还发现看似与癌变没有关系的基因突变影响着肿瘤的免疫原性,他们也是免疫应答的靶点。事实上,不仅黑色素瘤,在非小细胞肺癌中,也发现了多基因突变、多新生抗原的患者群,使用PD-1抗体后有效率高。另外,在早前的临床试验中发现PD-1抗体对结直肠癌患者无效,但是后来观察到基因不稳定性高的患者群,10人中有9人的肿瘤增殖得到抑制,与基因不稳定性低的患者群对比,显著地延长了生存期。这些都与免疫相关。
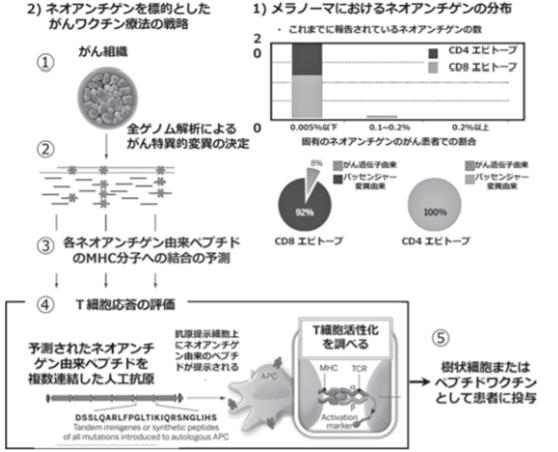
1) 黑色素瘤的新生抗原分布:能被CD8+T细胞识别的新生抗原有很多个。每2万人中不超过0.2%~0.05%,每个人都不同。到目前为止能鉴定出来的黑色素瘤新生抗原,几乎都不是从肿瘤驱动基因突变中获得的,而都来自过路基因突变。各癌种的基因突变可以在COSMIC中查询(http://cancer.sanger.ac.uk/cosmic)。基因由来地肽与MHC的结合预测可以在Net MHCVer.4.0(http://www.cbs. dtu.dk/services/NetMHC/),BIMAS(https://www―bimas. cit.nih.gov/molbio/hla_bind/)中检索。
2) 以新生抗原为靶点的癌症疫苗策略。①采集肿瘤患者的癌组织,进行二代全基因测序,需显示突变丰度。②预测基因突变的新生抗原,确定肿瘤新抗原。③预测各新抗原肽与MHC的结合配列。④确认T细胞是否与预测的新抗原肽反应。⑤用可以与T细胞反应的新抗原肽制作癌症疫苗。
6、靶向新生抗原的癌症疫苗
过去,即使鉴定出免疫原性高的突变抗原也无法对患者实施治疗,现在随着基因测序技术和各种科技的进步,迎来了肿瘤治疗的转折期。在动物试验领域利用疫苗抗肿瘤的文献络绎不绝。基于动物实验的科学证据,面向肿瘤患者,将新生抗原用作靶点的个性化癌症疫苗试验已经开始。对肿瘤进行全基因检测明确基因突变成为了治疗的基础,预测患者的MHC可结合肽的配列后,可以采用抗原肽疫苗的治疗方法,也可以采用多肽复合树突细胞疫苗的治疗方法(图3)。他们都是以新生抗原为靶点的免疫疗法,我们拭目以待,新生抗原疫苗否比过去的相关抗原疫苗更有效。
7、以肿瘤特意抗原为靶点的免疫疗法课题
临床取得的免疫学证据和技术革新,促成了以新生抗原为靶点的免疫疗法有可能实现癌症的个性化治疗。但目前仍然有很多课题需要解决。
1. 新生抗原的预测和如何证明免疫原性。
二代测序可以评估全基因的突变,目前所有癌症的基因突变数据已经被公开。利用基因突变引起的氨基酸置换,碱基插入或缺失导致的移码突变可以预测来自突变蛋白质的抗原肽,这些抗原肽就是免疫疗法的新生抗原靶点。但是有效抗肿瘤免疫反应需要:①新生抗原肽与MHC分子结合,并呈递给T细胞;②患者体内存在足够的可识别肿瘤的T细胞;③这些T细胞处于被激活状态。目前存在数种预测新抗原肽与MHC结合的方法,但是没有一种完美的,它们是否应答只能通过试验证实。还要考虑个体患者基因突变累积造成的肿瘤多样性,可能存在无数的候补新生抗原。从众多候补抗原中挑选出可以诱导抗肿瘤效果的方法还有待开发。
2. 以驱动基因突变和过路突变为靶点的免疫疗法有何区别。
人们尝试过开发针对p53、RAS等驱动基因突变的疫苗疗法,但迄今为止,仍未确立针对肿瘤特意性基因突变抗原的疗法,在抗PD-1抗体有效的肺癌和大肠癌患者中,p53和RAS突变高频出现,但没有发现针对他们的CTL增加。从结果推测,这些对于肿瘤的生存、增殖非常重要的免疫应答在肿瘤形成的初期就已经陷入免疫逃逸的状态。但有趣的是,在抗PD1抗体有效的肺癌患者中,随肿瘤的多样性而滋生的新生抗原并没有发生普遍的免疫应答,只有一些共性的单一新生抗原诱导了CTL。
包括共性的新生抗原,现在还无法解释已知驱动基因的免疫应答和这些共性的新生抗原应答有什么区别。今后在已知的疫苗知识基础上,研究如何预测挑选有效的新生抗原很重要。
8、总结
最近几年在癌症领域与免疫有关的文献数量急剧增加。许多临床试验和临床研究的结果,接二连三地告了新发现,充实了数据库。以免疫检查点抑制剂为代表的免疫疗法在实际临床运用才刚刚开始,对其治疗效果和副作用的预测,诊断和使用方法,以及与现有肿瘤治疗方法的联合还不明确,要走的路还很长。过去30~40年人们对免疫疗法的探索突然变得很怀旧。运用已知的知识和经验,进一步探索,期待肿瘤免疫疗法能有跨时代的飞跃。
参考文献
1) Hamid O. et al ., N. Engl. J. Med .,369,134―144(2013).
2) Callahan M. K. et al ., Front Oncol ,4,1―6(2014). 3) Maude S. L. et al ., N. Engl. J. Med .,371,1507―1517(2014).
4) Gattinoni L. et al ., Nat. Rev. Immunol .,6,383―393(2006).
5) Rossjohn J. et al ., Annu. Rev. Immunol .,33,169―200(2015).
6) Pierre G. Coulie. et al ., Nat. Rev. Cancer,14,135―146(2014).
7) McGranahan N. et al ., Science,351,1463―1469(2016).
8) Gubin M. M. et al ., Nature,515,577―581(2014).
9) Rizvi N. A. et al ., Science,348,124―128(2015). 10) Dung T. Le. et al ., N. Engl. J. Med .,372,2509―2520(2015).
11) Gros A. et al ., Nat. Med .,22,433―438(2016).
12) Rosenberg S. A., Restifo N. P., Science,348,62―68(2015).
13) Schumacher T. N., Schreiber R. D., Science,348,69―74(2015).
14) Kranz L. M. et al ., Nature,534,396―401(2016).
15) Traversari C. et al ., J. Exp. Med .,176,1453―1457(1992).
16) Rosenberg S. A. et al ., Nat. Med .,10,909―915(2004).
17) Sawada Y. et al ., Clin. Cancer. Res.,18,3686―3696(2012).
18) Sawada Y. et al ., Hum. Vaccin. Immunother.,9,1228―1233(2013).
19) 中面哲也ほか, 実験医学(増刊), 34, 55―60(2016).


